MEDICINA E FARMACOLOGIA
La maggior parte delle ricerche in biotecnologia è diretta alla diagnosi, terapia e prevenzione delle malattie dell’uomo. Sono infatti numerose le applicazioni biotecnologiche verso cui da anni si muovono le industrie farmaceutiche.
Le ricerche sono rivolte:
- alla produzione di proteine e peptidi per scopi terapeutici: ormoni, prodotti del sangue, farmaci antinfettivi e antiumorali, immunomodulatori e vaccini;
- allo sviluppo di reagenti e tecniche diagnostiche (anticorpi monoclonali, sonde molecolari a DNA, PCR) applicabili alle diverse malattie;
- alla terapia genica.
Prima dello sviluppo della tecnologia del DNA ricombinante, la maggior parte dei farmaci umani, di natura proteica, era disponibile in quantità molto limitate, sia per gli elevati costi di produzione sia perché il loro meccanismo d’azione non era ben caratterizzato. Inoltre, i prodotti ottenuti per estrazione dal sangue o da tessuti dell’uomo o di animali erano a rischio di trasmissione di malattie infettive da parte di microrganismi patogeni eventualmente presenti nei donatori. Con la tecnologia del DNA ricombinante questi inconvenienti vengono eliminati.
FARMACI
1) UN ESEMPIO ECLATANTE: L’INSULINA
L’insulina è stato il primo farmaco biotecnologico a essere messo in commercio nel 1982.
L’insulina è una proteina prodotta delle cellule β del pancreas e regola il metabolismo dei carboidrati nell’organismo. Sono molte le persone diabetiche, che sono cioè carenti di insulina.
Prima dell’82 era possibile somministrare solo insulina isolata dal pancreas di bovino o suino, con le problematiche sopra indicate.
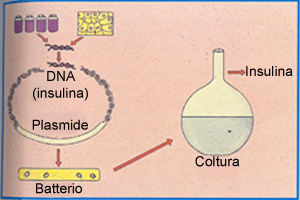
PRODUZIONE DELL’INSULINA UMANA CON LA TECNOLOGIA DEL DNA RICOMBINANTE: Le tappe del processo produttivo dell’insulina ricombinante non sono state semplici da realizzare poiché l’insulina nella sua forma attiva è costituita da due catene polipeptidiche (A e B). Il gene dell’insulina codifica per un’unica e lunga catena polipeptidica chiamata proinsulina, che viene poi convertita in insulina dalla cellula. Per risolvere questo problema sono stati usati diversi approcci al fine di produrre l’insulina umana in batteri ingegnerizzati:
1. la produzione di proinsulina, inserendo nei batteri il gene completo e quindi convertendo la proinsulina, prodotta dai batteri, in insulina, come avviene nelle cellule normalmente;
2. la produzione da parte di due colture batteriche separate (rispettivamente ingegnerizzate con i geni che codificano per le catene (A e B) delle singole catene polipeptidiche e quindi legandole chimicamente tra loro per ottenere la molecola attiva.
Per ottenere il gene dall’insulina umana da impiegare nei sopracitati approcci, è opportuno ricordare che l’isolamento di un gene, direttamente a partire dal genoma presente in un tessuto od organo umano, è estremamente complesso. Anche in questo caso sono possibili due diversi approcci:
1. isolare l’RNA messaggero che codifica per l’ormone insulina dalle cellule del pancreas che lo contengono in gran quantità e usare la trascrittasi inversa per fare una stampo di cDNA;
2. sintetizzare chimicamente in laboratorio il gene della proinsulina umana o delle singole catene dell’insulina umana legando nel corretto ordine le basi nucleotidiche desunte dalla sequenza di amminoacidi nella molecola della proinsulina e insulina.
Dopo aver ottenuto il gene, questo viene inserito nel batterio Escherichia coli. I batteri ricombinanti coltivati nei bireattori producono l’insulina umana e la secernono all’esterno, facilitandone l'estrazione.

2) Classifichiamo per categorie i principali farmaci disponibili o in fase di registrazione:
|
PRINCIPALI FARMACI PRODOTTI CON LA TECNICA DEL DNA RICOMBINANTE |
|
|
Categorie di prodotti |
Applicazione |
|
Ormoni e fattori di crescita Insulina Ormone della crescita Epidermal Growth Factor (EGF) Fibroblast Growth Factor (FGF) β-endorfine |
Terapia del diabete insulino-dipendente Terapia del nanismo Cicatrizzazione di ferite Trattamento delle ulcere Terapia del dolore |
|
Proteine del sangue Attivatore tissutale del plasminogeno (TPA) Fattori di coagulazione VII, VIII, IX Eritropoietina |
Dissoluzione di trombi e coaguli Terapia sostitutiva dell'emofilia Terapia dell'anemia (rigenerazione degli eritrociti) |
|
Immunomodulatori Interferoni
Interleuchine Tumor Necrosis Factor (TNF-α) Granulocyte-Colony Stimulating Factor (G-CSF) Granulocyte/Macrophage CSF (GM-CSF) |
Farmaci antivirali e antiumorali; Terapia del sarcoma di Kaposi (HIV-positivi) Terapia antiumorale e dei disordini immunitari Farmaco antiumorale Terapia di infezione (post-chemioterapia) Trapianto di midollo osseo, antiumorale |
|
Enzimi α-antitripsina Urochinasi Proteasi Idrolasi |
Terapia dell'enfisema Coagulazione del sangue Terapia di edemi e stati infiammatori Terapia di edemi e stati infiammatori
|
3) ANTIBIOTICI
Grazie all’ingegneria genetica è stata aumentata l’efficienza di produzione degli antibiotici in alcuni casi sino a 10000 volte. Si utilizzano ceppi microbici resi altamente resistenti all’antibiotico stesso mediante trasferimento nella cellula produttrice di un elevato numero di copie del plasmide responsabile dell’antibiotico resistenza: in tal modo il microrganismo non viene autoinibito dall’antibiotico che produce mentre continua a produrne elevate quantità.
Vi sono anche antibiotici prodotti attraverso il clonaggio dei geni degli antibiotici in modo da farli esprimere in idonee cellule ospiti. Il primo antibiotico di cui sono stati clonati i geni è l’eritromicina; Il processo per produrre questi antibiotici è stato molto complesso in quanto coinvolge decine di geni che devono venire clonati insieme e fatti funzionare in sequenza.
4) VACCINI
I vaccini classici sono soluzioni antigeniche contenenti batteri morti o virus attenuati. L’efficacia immunostimolante è molto varia .
Si è pensato allora di isolare le proteine immunogene: per i vaccini virali si tratta in genere di una proteina del guscio proteico (capside) o della membrana limitante esterna, mentre per vaccini batterici si tratta di proteine di adesione, che si trovano dunque all’esterno del batterio (es. antigeni delle fimbrie, ecc.) o di specifiche tossine modificate (anatossine).
Dopo la selezione del gene che codifica per la prescelta sub-unità proteica del microrganismo patogeno, il gene viene inserito in un idoneo vettore e trasferito in un microrganismo, che produrrà in grande quantità la proteina immunogena; questa verrà purificata e utilizzata come vaccino.
Per la produzione di vaccini vengono generalmente utilizzate cellule eucariote come lieviti, che possiedono plasmidi propri, cellule di insetti o mammifero, per una maggiore efficacia.
Il primo vaccino ricombinante è stato quello dell'epatite B. Il virus di questa malattia causa la cirrosi epatica ed è anche un agente cancerogeno del fegato. Applicando le tecniche dell'ingegneria genetica è stato clonato in un vettore il gene che codifica per l'antigene di superficie del virus e quindi trasferito ed espresso in lievito, Saccharomyces cerevisiae: il prodotto presenta tutte le caratteristiche dell'antigene.
Altri batteri sono patogeni per produzione di tossine. In questi casi si inducono mutazioni nello stesso ceppo patogeno e si selezionano quei ceppi che producono tossine batteriche modificate in modo tale da eliminarne la tossicità , ma mantenere l’effetto antigenico. L'esempio più interessante è il vaccino antipertosse.
Si utilizzano inoltre vaccini vivi ricombinanti, ossia batteri o virus GM.
5) ANTICORPI MONOCLONALI
Gli anticorpi monoclonali rappresentano dei reagenti immunologici utilizzati per diagnosticare (che consentono di rilevare con estrema semplicità e specificità) la presenza di un virus, di un batterio o di un parassita in un campione biologico (biopsia, liquido organico). Gli anticorpi reagiscono specificamente con gli antigeni dell’agente patogeno o con altre molecole antigeniche che vengono prodotte nelle cellule dell’organismo nel corso dell’infezione.
E’ possibile, impiegando sonde molecolari a DNA o la reazione PCR, svelare se alcuni geni presenti nelle cellule normali si sono modificati. La cellula tumorale produce peptidi e proteine, differenti per caratteristiche e/o quantità dai prodotti delle cellule normali; questi prodotti sono dunque marcatori tumorali che possono essere identificati con lo scopo di fare una diagnosi. L’identificazione di questi marcatori si realizza impiegando specifici anticorpi monoclonali, marcati con molecole radioattive, che vengono iniettati nel paziente e successivamente localizzati. La reazione può anche essere realizzata in vitro, impiegando liquidi biologici o cellule prelevate mediante biopsia , che vengono fatti reagire con anticorpi monoclinali anti marker tumorale, assieme a enzimi cromogeni; in questo caso la reazione è evidenziata con tecniche colorimetriche.
Tra i metodi più interessanti per le applicazioni diagnostiche degli anticorpi monoclonali sono da ricordare i marcatori dei tumori al seno, alla prostata, al pancreas e al fegato.
Questi anticorpi, inoltre, associati a farmaci, radioisotopi, sostanze di origine vegetale, hanno dato la possibilità di sviluppare farmaci antiumorali, i quali è possibile portare selettivamente alla cellula tumorale, che agiscono su di essa senza danneggiare le cellule sane. Il maggior problema è che bisogna inoculare più volte gli anticorpi monoclinali coniugati, poiché essendo derivati da topi vengono riconosciuti come non self e quindi eliminati. A questo si è risolto producendo anticorpi monoclinali chimerici, che conservano il sito reattivo dell’anticorpo del topo, ma le regioni costanti della molecola sono tipiche della specie cui appartiene il paziente.
6) ANIMALI TRANSGENICI
Le principali applicazioni degli animali transgenici sono:
1) modelli di patologie umane. Per molte malattie dell’uomo manca l’equivalente modello animale e ciò condiziona e ritarda molto le ricerche per lo sviluppo di molecole ad attività terapeutica per tali patologie. Grazie alle tecniche del DNA ricombinante è stato invece possibile produrre animali portatori di lesioni genetiche, identiche a quelle responsabili di alcune malattie ereditarie umane.
2) produzione di farmaci ricombinanti. Sono stati utilizzati animali transgenici in grado di secernere proteine o prodotti farmaceutici nel loro latte. I primi mammiferi utilizzati sono stati i topi. Nel 1987 è nato il primo animale transgenico in grado di produrre farmaci utili all’uomo: una topolina capace di secernere nel proprio latte una sostanza detta tPA ( attivatore tissutale del plasminogeno). Il tPA è un anticoagulante usato dopo un infarto per fluidificare il sangue.
3) donatori di tessuti e organi da trapiantare. Per ora applicazione ancora in fase di sviluppo.
Tra gli animali geneticamente modificati per produrre biofarmaci abbiamo:
- Tracey, pecora che codifica l’antitripsina, una sostanza chiave dell’organismo che in una persona su 2000 risulta carente provocando gravi malattie come la fibrosi polmonare, enfisema e cirrosi epatica.
- Herman, toro transgenico le cui figlie mucche producono latte con lattoferrina, proteina molto rara in grado di curare numerosi mali quali, dai tumori alle malattie del sistema immunitario, e che solo la specie umana era in grado finora di produrre nel latte materno..
- Genie, scrofa transgenica il cui latte contiene la proteina C del sangue umano.
- Rosie, mucca transgenica il cui latte contiene una proteina umana utile ai nati prematuri.
- Grace, capra transgenica nel cui latte è presente una proteina antitumorale.
- Polly, clone transgenico che contiene il gene per una proteina umana, il fattore IX.