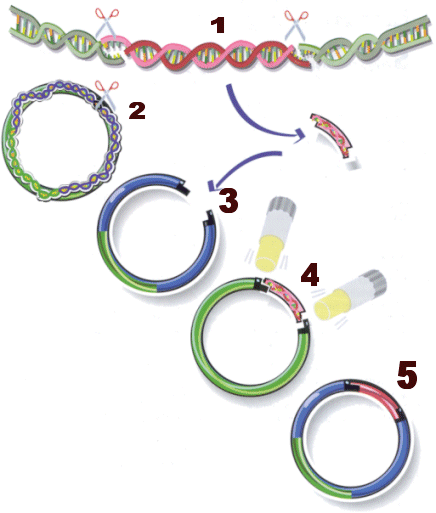
TECNICA USATA PER OTTENERE GLI OGM
La tecnica usata per la produzione di OGM può variare a seconda delle cellule utilizzate; le fasi salienti sono quattro, anche se in alcuni casi possono essere limitate a due:
. Isolamento del gene che si vuole trasferire, separandolo dal restante DNA mediante un enzima di restrizione;
. Inserimento del gene isolato in un vettore molecolare (plasmide batterico o virus) o direttamente nelle cellule vegetali, batteriche o animali di nostro interesse (in questo caso non c’è bisogno di ulteriori manipolazioni, basta mettere le cellule in coltura);
. Replicazione del batterio in modo da ottenere l’amplificazione del gene da trasferire;
.Trasferimento del plasmide, che veicola il gene nella cellula germinale di un’altra specie, ottenendo così un nuovo individuo con la capacità desiderate.

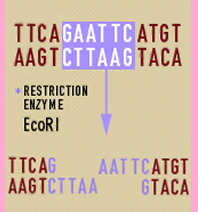
L'isolamento si effettua tramite gli enzimi di restrizione i quali sono complessi proteici scoperti in alcuni ceppi batterici e capaci di tagliare il DNA in corrispondenza di specifiche sequenze di basi, diverse per ciascun enzima, permettendo così di frammentare il genoma in maniera precisa e riproducibile. I tagli possono avvenire all’interno della catena, per opera delle endonucleasi, o alle estremità, per opera delle esonucleasi. L’utilizzo di questi enzimi ha permesso di isolare singoli frammenti di DNA. I ricercatori hanno individuato e usano diversi enzimi di restrizione, ognuno dei quali taglia entrambi i filamenti della doppia elica in corrispondenza di una specifica sequenza di coppie di basi. I tagli sono spesso sfalsati in modo che si formino frammenti provvisti di estremità a filamento singolo, dette estremità appiccicose o coesive. Poiché il taglio viene effettuato sempre in corrispondenza della stessa sequenza di basi per qualsiasi molecola di DNA, indipendentemente dalla sua provenienza (batterica, virale, eucariote), tutti i frammenti hanno estremità coesive complementari, che si uniscono spontaneamente.
Le tecniche che permettono l’inserimento di un gene o di un plasmide in una cellula batterica, vegetale, animale o in un protoplasto (ossia una cellula privata di parete e/o membrana cellulare) sono svariate; alcune di esse possono essere utilizzate per qualsiasi tipo di cellula mentre altre sono specifiche.
Le tecniche più diffuse sono:
. elettroporazione;
. metodo biolistico;
. PEG;
. utilizzo di agrobacterium;
. utilizzo di sali;
. coniugazione;
. microiniezione;
. fusione di protoplasti.
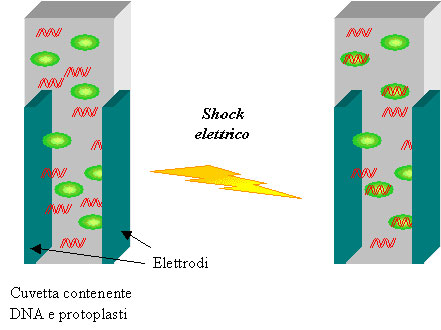
Elettroporazione
L’elettroporazione può essere applicata nella trasformazione di cellule provenienti da diversi organismi: animali, batteri e piante. Il metodo consiste nel sottoporre le cellule a uno shock elettrico in modo da rendere le membrane cellulari permeabili al DNA che si vuole inserire.
Una soluzione contenente un’alta concentrazione di DNA viene aggiunta a una sospensione di cellule animali o batteriche o protoplasti e la sospensione viene sottoposta a un campo elettrico. Lo shock elettrico provoca l’apertura dei pori presenti a livello della membrana plasmatica delle cellule o dei protoplasti permettendo l’entrata del DNA. In seguito all’elettroporazione le cellule o i protoplasti vengono fatti crescere in coltura prima di iniziare la selezione delle cellule che hanno integrato il DNA.
La limitazione principale dell’elettroporazione è dovuta alla necessità di dover utilizzare protoplasti e non cellule vegetali integre (con parete cellulare), con le difficoltà connesse alla rigenerazione di piante intere da essi.
Metodo biolistico
Il metodo biolistico è attualmente utilizzato per inserire geni estranei in cellule vegetali.
Con questa tecnica il DNA esogeno viene fatto aderire sulla superficie di microsfere di oro o tungsteno, di 1 micrometro di diametro, che vengono “sparate”, a una velocità intorno ai 500 m/sec, sui campioni da trasformare. Le cellule situate sulla traiettoria diretta di tiro vengono uccise, ma nella zona concentrica vicina i proiettili penetrano nelle cellule senza danneggiarle. Il vantaggio principale di questo metodo sta nella possibilità di trasformare cellule vegetali integre: infatti i bersagli utilizzati per questo tipo di trasformazione sono in genere colture di cellule embrionali, ma anche foglie e semi.
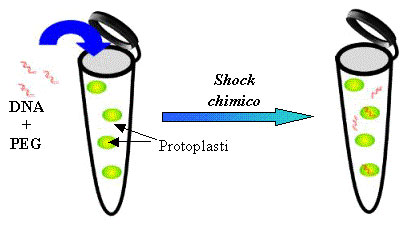
PEG: Polietilenglicolie
Nel metodo di trasformazione con PEG (sostanze, in parte di origine naturale, usate come emulsionanti, ossia per mescolare le parti oleose con quelle acquose) il DNA plasmidico penetra direttamente nei protoplasti o nelle cellule animali per assorbimento diretto, grazie all’azione del PEG che rende permeabili al DNA le membrane cellulari. Il PEG viene aggiunto a una soluzione contenente il DNA e i protoplasti o le cellule.
Utilizzo di Agrobacterium
Per il trasferimento di geni nelle cellule vegetali si è utilizzato, come primo vettore, il batterio Agrobacterium tumefaciens, che veicola il plasmide “Ti”, che ha la caratteristica di integrarsi efficientemente entro i cromosomi della pianta, la quale accoglierà così i geni nuovi precedentemente inseriti in questo plasmide. Poiché una caratteristica biologica del plasmide “Ti” (Tumour inducing) è quella di trasmettere tumori alle piante, gli ingegneri del gene sono riusciti a sfruttare le caratteristiche positive di questo plasmide (capacità di penetrare e integrarsi nel genoma della cellula vegetale), eliminando i geni responsabili del tumore, gli oncogeni T, e inserendo al loro posto il gene “passeggero” che si vuole trasferire alla pianta.
Successivamente si è osservato che anche il batterio Agrobacterium rhizogenes contiene un plasmide che può integrarsi parzialmente nel genoma delle piante e pertanto rappresenta un altro potenziale vettore. Questo plasmide, denominato “Ri” (Root inducing), presenta il vantaggio di indurre la formazione di radici invece di tumori, rendendo più facile la rigenerazione di piante modificate geneticamente.
Molte specie vegetali, tra le quali vi sono anche dei cereali di notevole importanza economica, non sono ospiti naturali di Agrobacterium.
Utilizzo di sali
I sali vengono utilizzati con lo scopo di creare pori nelle membrane cellulari rendendole così permeabili al DNA esogeno. Per quanto riguarda le cellule animali viene utilizzato il CaCl2 mentre per le cellule batteriche il Ca3(PO4)2.
Coniugazione
Il processo di coniugazione batterica avviene quando due cellule batteriche stabiliscono un contatto tramite un ponte citoplasmatico, conosciuto anche come pilo, e una delle due cellule, la donatrice, trasferisce il materiale genetico alla cellula ricevente. Attraverso questo processo un plasmide contenente le sequenze geniche di interesse può essere trasferito da una cellula batterica ad un’altra.
Microiniezione
Questa tecnica prevede l’inserimento, tramite una microsiringa, di piccole quantità di DNA, in genere un picolitro (10-12 litri), in una cellula animale. Di solito il DNA si inserisce il più precocemente possibile, vale a dire quando l’individuo è costituito da poche cellule o addirittura dall’oocita appena fecondato. Il gene inserito viene integrato nel genoma della cellula uovo e questa, trapiantata in una cellula ricevente, darà origine allo sviluppo e alla nascita di un animale transgenico.
In generale solo il 10-30% della progenie contiene il DNA estraneo in quantità costante in tutti i tessuti comprese le cellule germinali; pertanto il gene esogeno verrà trasmesso stabilmente alla progenie.
Fusione di protoplasti
La fusione dei protoplasti è una tecnica utilizzata per produrre ibridi cellulari. Le cellule parentali possono appartenere alla stessa specie o a due specie diverse. Queste vengono private delle pareti cellulari e trattate con PEG e sali di calcio e magnesio che servono alla fusione delle membrane e quindi l’unione di citoplasmi e nuclei delle cellule fuse. Questa fusione di cellule batteriche o di lievito serve quindi al rimescolamento dei patrimoni genetici delle due cellule e quindi all’acquisizione di nuovi caratteri da parte di uno dei due ceppi.
Per poter realizzare un OGM sono indispensabili altre tecniche di laboratorio che permettono di ottenere, purificare e identificare le sequenze genetiche di interesse. Tra queste tecniche vengono annoverati la PCR, l’utilizzo degli anticorpi monoclonali, delle sonde molecolari e dei geni marker:
PCR
La PCR (Polymerase Chain Reaction) è una tecnica che permette l’amplificazione enzimatica delle sequenze di DNA senza dover far uso di un organismo vivente come vettore (come E. Coli o cellule di lievito). Questa tecnica permette l’amplificazione esponenziale anche di piccole molecole di DNA; essendo però una tecnica in vitro non è adatta alla lavorazione di sequenza di DNA particolarmente lunghe.
Le altre tecniche di amplificazione richiedono l’utilizzo di vettori (plasmidi e virus) per trasferire il DNA da amplificare in cellule viventi dove verranno clonate. Tutto ciò si traduce in tempi lunghi e costi elevati. La PCR,invece, richiede esclusivamente la conoscenza delle sequenze adiacenti (primer) al frammento da amplificare e una polimerasi resistente alla temperatura. Viene usata la Taq polimerasi una polimerasi proveniente da un batterio, Thermus aquaticus, trovato nel geyser dello Yellowstone Park. Le sequenze di innesco della reazione, i primer, dei due opposti filamenti si estendono nelle due direzioni, l’uno verso l’altro. Alla fine della duplicazione del segmento fra i due primer, le due nuove coppie di filamenti complementari vengono denaturate innalzando la temperatura. Questi a loro volta fungeranno da stampo per una successiva duplicazione, abbassando la temperatura e sempre in presenza della Taq polimerasi. Ripetuti cicli di replicazione e denaturazione permettono un incremento esponenziale delle copie di DNA.
Un tipico
ciclo di PCR prevede quattro fasi principali che si ripetono più volte:
1. Denaturazione al calore di uno stampo di DNA che deve
essere copiato (94 – 99 °C)
2. Appaiamento (annealing) di coppie di oligo, (30 – 65 °C)
3. Estensione da parte di DNApol termoresistente (Taq polimerasi) a
partire dai primer. (65 – 72°C)
4. Legame dei frammenti opposti dello stesso segmento tramite l’enzima ligasi.
ANTICORPI MONOCLONALI
I prodotti finali dell’ingegneria genetica sono in genere proteine e per identificare la loro produzione e per purificarle dalle numerose altre sostanze contenute nelle colture di massa di batteri ricombinanti, si possono impiegare reazioni di tipo immunologico, si possono cioè sfruttare le loro caratteristiche antigeniche. E’ perciò indispensabile poter disporre, ad esempio, di anticorpi a elevata specificità da usare per le finalità descritte. Questi anticorpi sono definiti monoclonali.
. Si inocula ripetutamente l’antigene, verso cui si vogliono produrre gli anticorpi, in un topo;
. Dopo alcune settimane la milza conterrà un gran numero di cellule capaci di produrre anticorpi specifici;
. Viene fatta l’ibridazione cellulare, ossia la fusione tra una cellula di un anticorpo e una cellula tumorale, ottenendo una cellula sola, che eredita dalle cellule progenitrici, oltre ai cromosomi, anche le loro caratteristiche biologiche, quali ad esempio la capacità a realizzare sintesi proteiche desiderate e la produzione di essi;
. Tra le numerose cellule ibride ottenute si individuano, mediante clonazione, le singole cellule che producono gli anticorpi interessati;
. Si avrà alla fine a disposizione una fonte inesauribile di anticorpi purissimi.
SONDE MOLECOLARI
Un’operazione difficile nella clonazione genica è quella di identificare il clone batterico o fagico che contiene il gene desiderato. I metodi più utilizzati per individuare direttamente un gene si basano tutti sull’accoppiamento tra le basi azotate del gene in questione e quelle di una sequenza complementare appartenente ad un’altra molecola di DNA o RNA. Questa molecola è chiamata sonda, perché viene usata per trovare una specifica sequenza nucleotidica all’interno di un certo quantitativo di DNA:
. Il campione di DNA che deve essere analizzato viene o scaldato o trattato con sostanze basiche per separare i filamenti di DNA;
. La sonda viene mescolata con questi filamenti;
. La sonda individua la molecola giusta formando legami idrogeno con la sequenza complementare del gene ricercato.
GENI MARKER
Nelle
cellule e nei protoplasti vengono introdotte, insieme alle
sequenze geniche di interesse, altre sequenze geniche, dette geni marker,
necessarie per discriminare in fase di laboratorio le cellule vegetali
trasformate dalle non trasformate.
Il gene marker permette una prima e veloce identificazione delle cellule o
dei tessuti che hanno integrato il transgene nel loro genoma. Questo passaggio
è di fondamentale importanza perché l’integrazione e l’espressione del
transgene è in realtà un evento molto raro ed avviene con frequenze molto
basse. I geni marker codificano per proteine, in genere enzimi, che
conferiscono, nelle piante che li contengono, resistenza a sostanze normalmente
tossiche.
Nella
maggior parte dei casi il gene marker conferisce la resistenza a un
antibiotico. Le cellule sottoposte a trasformazione vengono fatte crescere su
terreno selettivo dove solo le cellule o i tessuti che hanno integrato il gene
marker, e quindi anche il gene di interesse, riescono a crescere in presenza
dell’antibiotico appropriatamente aggiunto al mezzo di coltura.